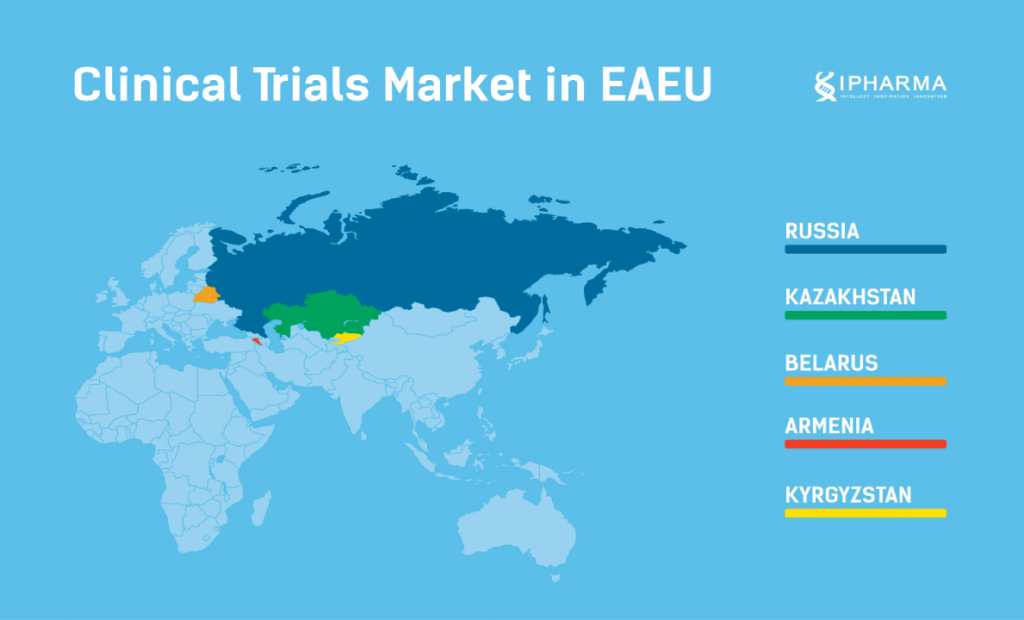
Евразийский экономический союз (ЕЭС) продолжает совершенствовать законодательство для проведения клинических исследований и регистрации лекарственных препаратов на своей территории.
В регионе имеются лидеры по количеству проводимых клинических исследований, такие как Россия и Беларусь. Эти страны обладают большим количеством опытных исследовательских центров, удобной регуляторной средой и развитой инфраструктурой для проведения клинических исследований.
Кроме того, существует ряд стран, где рынок клинических исследований находится в стадии начального роста. Ожидается, что благодаря гармонизации процессов между странами, этот рынок будет активно развиваться.
Регион имеет явные преимущества по сравнению с другими странами в проведении клинических исследований. Лидерами ЕЭС по количеству проводимых исследований остаются Россия и Беларусь, благодаря следующим факторам: большой пул пациентов, невысокие затраты на сервисы и оплату работы исследователей, благоприятная регуляторная среда, высокая экспертиза исследовательских команд и специалистов клинических исследований, работающих в CRO и компаниях-спонсорах.
Рассмотрим подробнее эти преимущества:
- Наличие пула пациентов. Страны ЕЭС имеют централизованную систему здравоохранения, благодаря чему пациенты с одинаковыми заболеваниями наблюдаются в специализированных госпиталях, что облегчает их поиск. При этом пациенты имеют высокую приверженность к следованию процедурам протокола клинических исследований из-за регулярных медицинских обследований. Ограниченные возможности системы здравоохранения в отношении некоторых заболеваний, например, онкологии и орфанных заболеваний, также играют свою роль.
- Большое количество опытных исследовательских команд. В странах ЕЭС работают команды с опытом в международных клинических исследованиях и прохождении инспекций FDA и EMA. Стоимость услуг и выплат ЛПУ и исследователям в этих странах значительно ниже по сравнению с Западной Европой и США.
- Благоприятная регуляторная среда. Например, в России, с учетом планируемых изменений законодательства, получение разрешения на проведение клинического исследования занимает 31 рабочий день, а разрешение на ввоз исследуемого препарата и вывоз биообразцов — до 5 рабочих дней. От момента подачи документов в Минздрав до включения первого пациента в исследование может пройти всего 3 месяца, что встречается достаточно часто.
- Развитая медицинская инфраструктура. В регионе имеются исследовательские центры, способные проводить сложные клинические исследования, включающие большое количество диагностических и инвазивных процедур. Это особенно актуально для таких сложных исследований, как онкология, онкогематология и аутоиммунные заболевания.
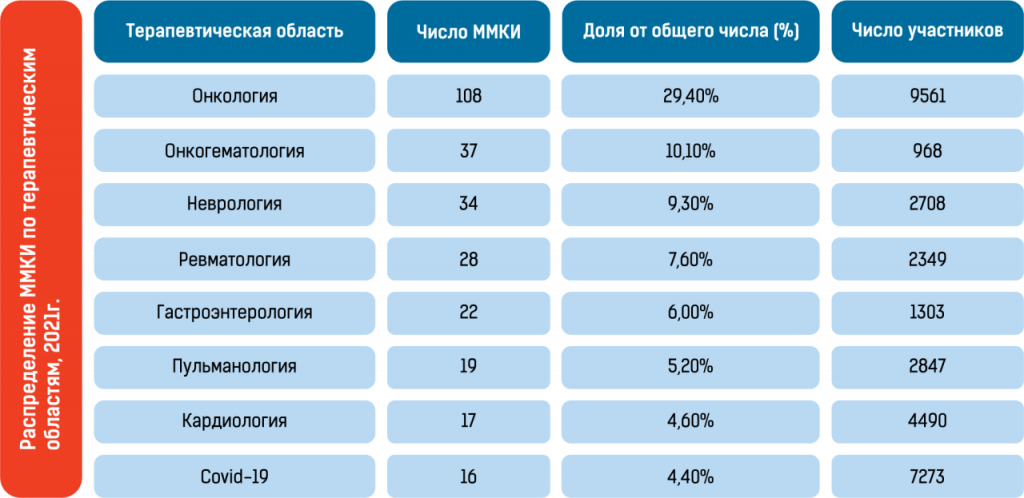
Статистика по проведённым международным клиническим исследованиям подтверждает эти преимущества:
Таким образом, наличие большого пула пациентов, централизованная система здравоохранения, высокая приверженность пациентов к соблюдению протокола, наличие крупных исследовательских центров с развитой инфраструктурой и короткие сроки одобрения клинических исследований позволяют быстрее набирать пациентов и сокращать общие сроки клинической разработки.