Новый сервис от компании «Ифарма»: контроль за ходом исследования в режиме «единого окна»
Компания «Ифарма» разработала новый сервис, который позволяет сотрудникам компаний-спонсоров контролировать ход клинических исследований. Платформа интегрирована с системой электронного сбора и анализа данных участников и предоставляет информацию о наборе участников, нежелательных и серьёзных нежелательных явлениях, ответах на запросы и заполнении индивидуальной регистрационной карты.
Сервис доступен в режиме «одного окна», что позволяет быстро и удобно получать данные о ходе исследований. Сотрудники компаний-спонсоров могут отслеживать актуальную информацию и оперативно реагировать на любые изменения.
Платформа предоставляет возможность просматривать данные как в необработанном, так и в агрегированном формате. Это позволяет использовать их для внутрикорпоративных отчётов и предоставления менеджменту компании.
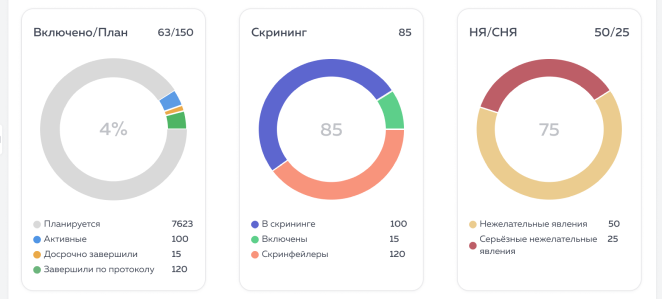
Данные в необработанном формате представляют собой исходную информацию, полученную из системы электронного сбора данных. Они могут быть полезны для детального анализа и понимания конкретных аспектов исследования.
Агрегированные данные представляют собой обобщённую информацию, которая может быть полезна для быстрого обзора хода исследования и выявления общих тенденций.
Благодаря новому сервису сотрудники компаний-спонсоров получают возможность сосредоточиться на обсуждении конкретных вопросов с менеджером проекта, а не тратить время на поиск и анализ информации о ходе исследования.
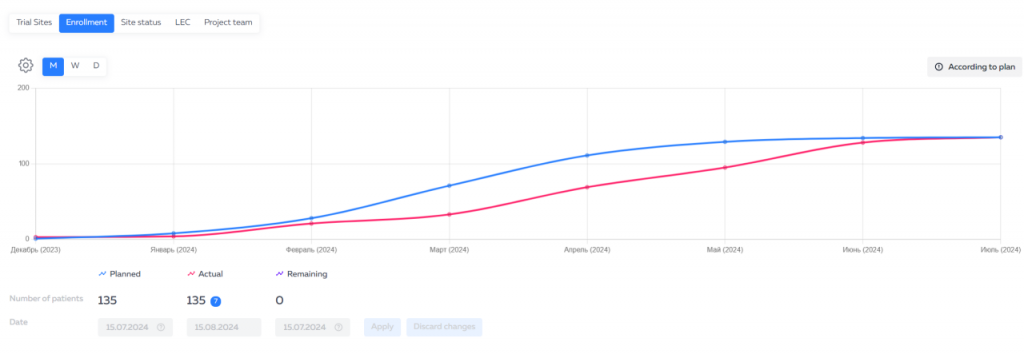
Это инновационное решение от компании «Ифарма» значительно упрощает процесс контроля за клиническими исследованиями и повышает эффективность работы сотрудников компаний-спонсоров. Сервис уже получил положительные отзывы от первых пользователей и продолжает развиваться, чтобы предоставлять ещё более удобные инструменты для управления исследованиями.
Как работает сервис?
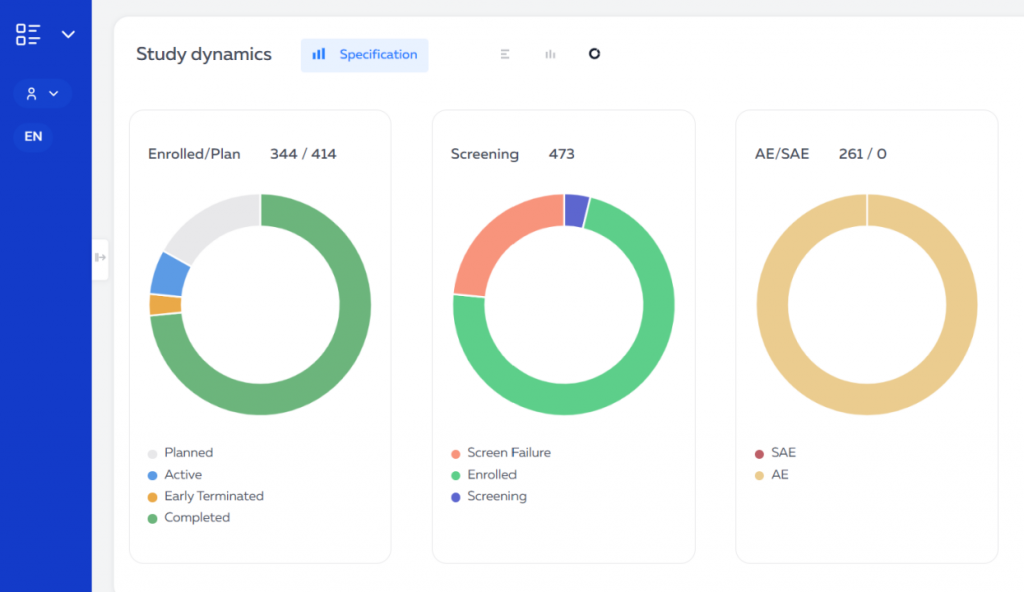
Сотрудники компаний-спонсоров имеют доступ к платформе через веб-интерфейс или мобильное приложение. Они могут просматривать различные показатели хода исследования, такие как набор участников, нежелательные явления, ответы на запросы и заполнение индивидуальной регистрационной карты.
Для удобства использования данные представлены в виде дашбордов — информационных панелей, которые позволяют быстро получить обзор хода исследования по ключевым показателям. Дашборды можно настроить под свои потребности, выбрав необходимые показатели и фильтры.
Таким образом, новый сервис от компании «Ифарма» является удобным инструментом для контроля за ходом клинических исследований и повышения эффективности работы сотрудников компаний-спонсоров.